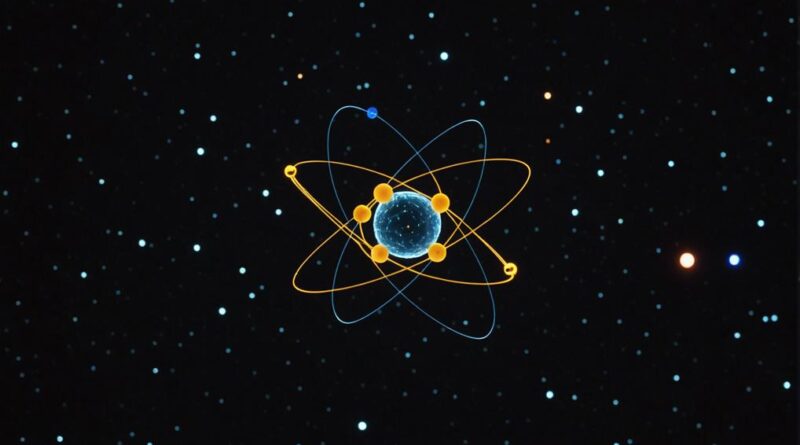
Se você pensar na estrutura de um átomo, Modelo Rutherford é um conceito-chave que não pode ser esquecido. A inovação de Ernest Rutherford Experimente com folha de ouro em 1911 mostrou um núcleo denso e carregado positivamente no centro do átomo, cercado por elétrons em órbita. Este modelo mudou fundamentalmente a maneira como os cientistas viam as coisas estrutura atômica e lançou as bases para avanços futuros na teoria nuclear. No entanto, o modelo de Rutherford tem limitações, particularmente na explicação Estabilidade eletrônica e níveis de energia. Então, quais foram essas limitações e como elas moldaram o caminho para a teoria atômica moderna?
As teses centrais
- O modelo de Rutherford introduziu um núcleo denso e carregado positivamente no centro do átomo.
- Os elétrons orbitam o núcleo de um átomo em grande parte no espaço, semelhante à forma como os planetas orbitam o sol.
- O experimento solar sobre dispersão de partículas alfa forneceu evidências do modelo nuclear do átomo.
- O modelo de Rutherford explicava que a maior parte da massa atômica estava concentrada no núcleo.
- O modelo tinha limitações para explicar a estabilidade dos elétrons e a radiação energética, o que levou a novos avanços.
Contexto histórico

Ernest Rutherford propôs seu modelo atômico revolucionário em 1911, após seu inovador Experimente com folha de ouroEsta experiência inovadora mudou fundamentalmente a compreensão do estrutura atômicaAntes de Rutherford ser JJ Thomsons Modelo de pudim de ameixa foi amplamente aceito e descreveu o átomo como uma nuvem difusa de carga positiva com elétrons embutidos nela.
Durante o experimento da folha de ouro, Rutherford liderou Partículas alfa em uma fina placa de ouro. Para sua surpresa, embora a maioria das partículas tenha passado pelo objeto, algumas foram desviadas em grandes ângulos. Este resultado inesperado levou Rutherford a concluir que o átomo era um átomo pequeno, denso, núcleo carregado positivamenteque ele chamou de núcleo. Em torno deste núcleo Os elétrons orbitam como planetas ao redor do Sol, mostrando que a maior parte do Sol está no espaço.
O modelo atômico de Rutherford foi um enorme avanço na Teoria nuclear. Substituiu o ultrapassado modelo do pudim de ameixa e introduziu a ideia de um núcleo compacto no centro do átomo. Este núcleo carregado positivamente mudou fundamentalmente a percepção da comunidade científica sobre a estrutura atômica e lançou as bases para futuros avanços na física nuclear e o subsequente desenvolvimento de Teoria quântica.
Ernest Rutherford: o cientista
Com base nas descobertas monumentais de seu Experimente com folha de ouroA curiosidade incansável e o espírito pioneiro de Rutherford consolidaram seu lugar como um dos cientistas mais influentes da história. O cientista britânico Ernest Rutherford propôs seu revolucionário Modelo átomo em 1911 e mudou fundamentalmente a compreensão científica da estrutura atômica.
Rutherford descobriu que os átomos contêm um núcleo denso e carregado positivamente através de seu cuidadoso experimento partículas subatômicasque carregam a maior parte da massa atômica.
O trabalho de Rutherford não se limitou à identificação do núcleo atômico; ele mostrou isso Órbita de elétrons esse núcleo central. Para que possamos teorias existentesele lançou as bases para teoria atômica moderna. Seu experimento com folha de ouro mostrou que a maioria das partículas passava direto pela folha, mas algumas eram desviadas em ângulos agudos, levando-o a concluir a existência de um núcleo pequeno, denso e carregado positivamente.
A introdução do Conceito de carga nuclear foi inovador. O modelo atômico de Rutherford mostrou que o átomo não é apenas um pedaço positivo e partículas carregadas negativamente mas uma unidade estruturada com um núcleo central. Suas descobertas moldaram fundamentalmente nossa compreensão das partículas atômicas e subatômicas e fizeram de Ernest Rutherford uma pedra angular da física moderna.
Experimento de dispersão de partículas alfa

Em 1909, o experimento de dispersão de partículas alfa de Ernest Rutherford forneceu insights inovadores sobre a estrutura atômica. Nesta experiência crucial, uma fina folha de ouro foi bombardeada com partículas alfa.
Na época, o modelo atômico dominante era o modelo do pudim de ameixa, que presumia que os átomos consistiam em uma nuvem difusa de carga positiva com elétrons carregados negativamente embutidos nela. No entanto, o experimento da folha de ouro de Rutherford pintou um quadro diferente.
Quando as partículas alfa foram desviadas em ângulos diferentes, mostrou que os átomos têm um núcleo pequeno, denso e carregado positivamente. Este núcleo é agora chamado de núcleo atômico. A maioria das partículas alfa penetrou diretamente através da fina folha de ouro, mas algumas foram fortemente desviadas, inconsistente com o modelo do pudim de ameixa.
Esses desvios levaram Rutherford a propor o modelo nuclear do átomo, o que mudou fundamentalmente a compreensão da estrutura atômica. Este experimento evocou fortes emoções e percepções:
- surpreender: A descoberta de um núcleo atômico denso foi inesperada.
- revolução: Virou de cabeça para baixo o modelo existente de pudim de ameixa.
- curiosidade: Os cientistas estavam entusiasmados para explorar o novo modelo atômico.
- inspiração: Abriu caminho para avanços futuros na física nuclear.
O experimento de dispersão de partículas alfa de Rutherford foi um passo inovador na revelação da verdadeira natureza da estrutura atômica.
Observações importantes
O Experimento de dispersão de partículas alfa revelou que a maioria das partículas passa diretamente através do Folha de ouroo que indica que o O átomo consiste principalmente em espaço. No entanto, algumas partículas foram desviadas em ângulos diferentes e algumas até retornaram. Este comportamento inesperado levou à descoberta inovadora de que os átomos… núcleo pequeno e denso no centro deles.
No modelo atômico de Rutherford, este núcleo é um núcleo carregado positivamente que contém a maior parte da massa atômica. A experiência mostrou que este núcleo é minúsculo comparado com o tamanho total do átomo, razão pela qual a maioria das partículas alfa foram capazes de penetrar na folha de ouro com pouca ou nenhuma distração. Este núcleo carregado positivamente repeliu as partículas alfa carregadas positivamente, fazendo com que elas se dispersassem.
As observações de Rutherford também levaram à conceituação do Modelo planetário do átomoNeste modelo, os elétrons orbitam o núcleo como os planetas orbitam o Sol, criando um especialmente espaço. O O experimento de dispersão de partículas alfa foi crucial para mudar a compreensão científica dos modelos anteriores para os Modelo nuclearenfatizando o núcleo denso cercado por elétrons em órbita. Este modelo constitui a base de grande parte do teoria atômica moderna.
O modelo nuclear

O modelo nuclear de Rutherford revolucionou nossa compreensão da estrutura atômica ao introduzir um núcleo denso e carregado positivamente no centro do átomo. Este conceito surgiu do famoso experimento da folha de ouro, no qual partículas alfa foram direcionadas para uma fina camada de ouro. Em contraste com o modelo do pudim de ameixa de J. J. Thomson, que propunha uma carga positiva difusa, as observações de Rutherford mostraram que os átomos consistem em um núcleo pequeno e denso cercado por elétrons.
O modelo de Rutherford mostrou que:
- Os átomos são feitos principalmente de espaço.
- O núcleo contém a maior parte da massa atômica.
- Os elétrons orbitam o núcleo, semelhante à forma como os planetas orbitam o sol.
- O nuSunus tem carga positiva e atrai elétrons com carga negativa.
Essas descobertas refutaram o modelo do pudim de ameixa, que presumia que os elétrons estavam incorporados em uma “sopa” carregada positivamente. Em vez disso, o modelo de Rutherford destacou a estrutura do átomo como um núcleo rodeado por electrões, mudando fundamentalmente a nossa compreensão da estrutura atómica.
Imagine o impacto da descoberta de que o átomo, antes considerado uma entidade homogênea, na verdade tem um núcleo bem definido e carregado positivamente. Este minúsculo núcleo contém a maior parte da massa atômica, e os elétrons que o rodeiam determinam seu tamanho e propriedades químicas.
Impacto na teoria atômica
A descoberta de Rutherford do Núcleo atômico mudou nossa compreensão da estrutura atômica e lançou as bases para teoria atômica modernaSeu modelo mostrou que o átomo está concentrado em um núcleo denso e carregado positivamente, que é o núcleo existente Modelo de pudim de ameixa. O núcleo carregado positivamente ocupa apenas uma pequena fração do volume do átomo, deixando uma enorme quantidade de espaço restante.
O modelo de Rutherford teve um impacto profundo na teoria atômica ao mostrar que Órbita de elétrons este núcleo, semelhante à forma como os planetas orbitam o sol. Esta percepção foi revolucionária e sugeriu uma estrutura dinâmica em vez de estática. A ideia de um essencial também abriu as portas para o estudo da física nuclear e lançou as bases para o estudo das interações e estabilidade atômicas.
Além disso, os insights de Rutherford encorajaram o desenvolvimento de Mecânica quântica. Ao enfatizar o papel do núcleo carregado positivamente e o comportamento dos elétrons, seu modelo exigiu uma nova forma de compreendê-los. partículas subatômicas'Movimentos e energias.
As contribuições de Rutherford continuam sendo parte integrante das teorias da estrutura atômica hoje e inspiram continuamente a comunidade científica a avançar e pesquisar. O legado do seu modelo molda inegavelmente a nossa compreensão da natureza complexa do átomo.
Limitações do modelo Rutherford

Apesar dos seus insights revolucionários, o modelo de Rutherford não conseguiu explicar por que os átomos permanecem estáveis. O modelo presumia que os elétrons orbitavam o núcleo atômico, mas faltava um mecanismo para manter essa configuração sem que os elétrons espiralassem em direção ao núcleo atômico devido à sua carga negativa. Isto levantou sérias questões sobre a estabilidade dos átomos.
A teoria do eletromagnetismo de Maxwell presumia que qualquer partícula carregada em movimento, como um elétron em órbita, deveria emitir radiação. Essa radiação faria com que o elétron perdesse energia e eventualmente colapsasse no núcleo. Esta contradição destacou uma limitação significativa na teoria atômica de Rutherford. Além disso, o modelo não especificou como os elétrons estão dispostos em suas órbitas, deixando uma lacuna na compreensão da estrutura nuclear.
O modelo de Rutherford também não conseguiu explicar certos resultados experimentais, como as linhas espectrais discretas observadas nos espectros de emissão atômica. Esta lacuna destacou a necessidade de uma teoria mais abrangente, o que levou ao desenvolvimento da mecânica quântica.
O modelo de Rutherford era inadequado pelas seguintes razões:
- Falta um mecanismo para explicar as órbitas e a estabilidade dos elétrons.
- Incapacidade de resolver o problema da energia radiante e do colapso em massa.
- Erro ao especificar o arranjo dos elétrons dentro do átomo.
- Incompatibilidade com resultados experimentais observados.
Essas limitações destacaram a necessidade de avanços na teoria atômica.
Progresso além de Rutherford
Como Niels Bohr expandiu as fronteiras da teoria atômica além dos limites do modelo de Rutherford? Bohr introduziu a ideia revolucionária de níveis de energia quantizados, permitindo que os elétrons orbitassem o núcleo atômico em órbitas fixas sem irradiar energia. Este conceito de órbitas eletrônicas estáveis resolveu o problema de instabilidade do modelo de Rutherford e permitiu uma compreensão mais clara da estrutura atômica.
O modelo de Bohr foi inovador porque incorporou elementos da teoria quântica para explicar o comportamento dos elétrons e dos níveis de energia. Ao fazer isso, lançou as bases para o desenvolvimento da teoria quântica moderna. Aqui está uma comparação para ilustrar o progresso:
| aspecto | Modelo de Rutherford | Modelo de Bohr |
|---|---|---|
| Órbitas de elétrons | Instável, indefinido | Órbitas fixas e estáveis |
| Níveis de energia | Não especificado | Níveis de energia quantizados |
| Estabilidade atômica | Instável | Estábulo |
| Fundação para Mecânica Quântica | Nenhum | Fundado |
Os insights de Bohr sobre os níveis de energia quantizados e o comportamento dos elétrons refinaram nossa compreensão da estrutura atômica. O seu modelo não apenas corrigiu a abordagem de Rutherford; também lançou as bases para novos avanços na mecânica quântica. Ao levar em conta esses aspectos críticos, o modelo de Bohr tornou-se um marco crucial no desenvolvimento da teoria atômica moderna.
Aplicações modernas

Ao explorar aplicações modernas, você verá como os princípios do Modelo Rutherford continuam a influenciar os avanços na tecnologia e na pesquisa científica hoje. O modelo, que introduziu o conceito de núcleo carregado positivamente, denominado núcleo atômico, revolucionou nossa compreensão da estrutura atômica. Este núcleo, rodeado por elétrons, constitui a base para inúmeras descobertas científicas.
- Imagens médicas e tratamentos: Técnicas como ressonância magnética e PET são baseadas na compreensão de como os elétrons estão incorporados no átomo e como as partículas carregadas positivamente se comportam. Esses métodos ajudam a diagnosticar e tratar doenças de forma mais eficaz.
- Energia nuclear: Experimento de Rutherford – O modelo nuclear desempenha um papel importante nos reatores nucleares. O conhecimento de que um átomo é constituído por um núcleo denso controla o processo de fissão, que libera enormes quantidades de energia.
- acelerador de partículas: Essas máquinas, usadas em pesquisa e medicina, baseiam-se na atração eletrostática dentro dos átomos. Compreender como um elétron orbita o núcleo é crucial para a manipulação de partículas subatômicas.
- Mecânica quântica: O modelo atômico de Bohr, que refinou o trabalho de Rutherford, é fundamental para a teoria quântica. Os insights sobre a distribuição da massa atômica e a interação de partículas com carga positiva estão impulsionando inovações em nanotecnologia e semicondutores.
Estas aplicações ilustram o legado duradouro do modelo de Rutherford na ciência e tecnologia modernas.
Conclusão
Agora você tem o inovador Modelo Rutherford do átomo. Compreender o seu significado histórico e as principais observações do Experiência sobre a dispersão de partículas alfa lhe ensinou como as descobertas de Rutherford mudaram a teoria atômica.
Ao reconhecer o restriçõesEles também apreciam o seu papel na preparação do caminho para avanços como o modelo de Bohr e Mecânica quântica.
Lembre-se de que o trabalho de Rutherford demonstra a evolução da pesquisa científica e constitui a base para aplicações modernas em química e física.
Perguntas frequentes
1. Qual é o modelo atômico de Rutherford?
O modelo do átomo de Rutherford, proposto por Ernest Rutherford em 1911, descreve o átomo como tendo um núcleo pequeno e denso contendo prótons e orbitado por elétrons. Este modelo substituiu o modelo anterior “Plum Pudding” da Thomson.
2. Como Rutherford descobriu o núcleo?
Rutherford descobriu o núcleo através do experimento da folha de ouro. Ao observar a deflexão das partículas alfa que passam através de uma fina folha de ouro, ele concluiu que deveria haver um núcleo pequeno, denso e carregado positivamente no centro do átomo.
3. Que influência o modelo de Rutherford teve na teoria atômica?
O modelo de Rutherford revolucionou a teoria atômica ao introduzir o conceito de núcleo atômico central e levar ao desenvolvimento do modelo atômico moderno. Lançou as bases para futuras descobertas, incluindo a identificação de nêutrons e o desenvolvimento da mecânica quântica.