¿Qué es una batería?
Una batería es un dispositivo electroquímico que puede almacenar energía en forma de energía química. Esto se traduce en energía eléctrica cuando la batería se conecta en un circuito debido al flujo de electrones debido a la colocación específica de productos químicos. Fue inventada por Alessandro Volta, mientras que Gaston Plante inventó la batería recargable.
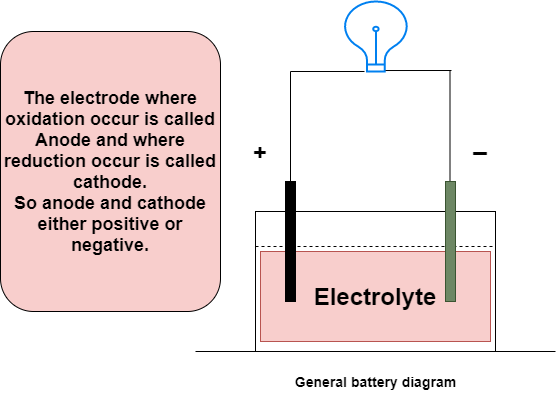
La batería se compone de tres elementos: el lado negativo, el lado positivo y el electrolito (la sustancia química que reacciona con ambos lados), como se muestra en la imagen siguiente. El electrolito se utiliza como medio de transporte de electrones entre el ánodo y el cátodo.
Funciona debido a reacciones electroquímicas llamadas oxidación y reducción. En esta reacción, los electrones fluyen de un lado a otro cuando el circuito externo está conectado al ánodo y al cátodo.

Diagrama general de baterías.
La química de la batería puede variar según las diferentes aplicaciones, especificaciones, tamaños, etc., que se explican a continuación en los tipos de batería.
Aplicaciones de batería
La batería se utiliza en aplicaciones donde es necesario almacenar energía para fines futuros. Los dispositivos portátiles, de emergencia y de bajo consumo suelen utilizar baterías. Un dispositivo portátil, como un portátil móvil, tiene una batería para utilizarla donde quieras. Cuando no hay electricidad se utiliza un dispositivo de emergencia como inversor, antorcha, etc. Los dispositivos de bajo consumo de energía, como relojes, oxímetros, etc., pueden funcionar durante mucho tiempo después del reemplazo de la batería. La red eléctrica no es adecuada para todas las situaciones.
Los requisitos de una batería dependen de varias condiciones, como cuánta energía se necesita o qué tan portátil es el dispositivo. Pero ¿qué pasa con el reloj de pared? ¿Por qué no está conectado a un tomacorriente?
El reloj de pared consume muy poca energía. Una batería de 1,2 V puede durar casi dos años, pero esa no es la razón principal. El reloj debe estar encendido en todo momento para obtener la hora correcta; Esto se puede hacer con batería. Un solo obstáculo en el poder provocará un retraso en el tiempo. Es por eso que está diseñado para funcionar con menos energía, lo que permite que el reloj funcione durante más tiempo y hace que la batería sea una forma eficiente de proporcionar energía constantemente.
Veamos otro ejemplo. Generalmente un vehículo funciona con gasolina. En un vehículo de arranque automático, el encendido inicial del motor se realiza mediante una bobina de encendido y un motor. El motor se utiliza para alcanzar rpm específicas del motor y la bobina de encendido se utiliza como fuente de ignición. La bobina de encendido de este vehículo consume aproximadamente cuatro amperios. Esta corriente puede variar entre distintos fabricantes y hay mucho espacio en el vehículo. Es por eso que, para cumplir con los requisitos de corriente más altos, la batería de plomo-ácido es perfecta para esto.

Encendido del vehículo.
Del ejemplo anterior, podemos decir que el uso de baterías depende de la condición y la aplicación.
tipos de baterias
Según su funcionalidad, existen dos tipos de baterías disponibles en el mercado.
- Baterías primarias.
- Baterías secundarias.
Baterías primarias
Las baterías fabricadas para un solo uso y que no pueden recargarse se denominan baterías primarias . Este tipo de batería se desecha después de su uso. También se las conoce como baterías no recargables . Es una fuente de energía muy sencilla y cómoda para dispositivos portátiles como relojes, cámaras, linternas, etc. La batería viene en tamaño estándar como se muestra a continuación.

El tamaño de batería estándar
Estas baterías son económicas, pequeñas, livianas y requieren poco o ningún mantenimiento.
Algunas baterías primarias comunes
- Pila alcalina
La batería alcalina se compone principalmente de zinc y dióxido de manganeso como electrodos. El electrolito alcalino se utiliza como hidróxido de potasio o sodio. Como puede ver en la imagen a continuación, la carcasa exterior es un tambor de acero y hay una tapa en el tambor que es un terminal positivo. En el interior de este tambor se funde dióxido de manganeso (MnO2) de grano fino mezclado con polvo de carbón, como se muestra en la imagen. Esta mezcla fundida forma parte del cátodo de una batería alcalina. Hay otro polvo dentro del polvo del cátodo, que es polvo de zinc con hidróxido de potasio. El polvo de zinc (Zn) forma parte del ánodo de una batería alcalina. Ambos polvos se separan mediante un separador de papel. El separador de papel está empapado en hidróxido de potasio, un electrolito entre el cátodo (MnO2) y el ánodo (Zn). El pasador de metal de latón se inserta junto con el eje central de la batería alcalina, que es un pasador colector negativo. El pasador está en contacto con el extremo metálico. Hay una cubierta de plástico que separa el extremo metálico del tambor de acero. El extremo metálico es el terminal negativo de una batería alcalina.

Pila alcalina
Esta batería se utiliza donde se requiere bajo voltaje. Una sola celda puede suministrar 1,5 V. Esto es muy económico, por lo que puede reducir el costo del producto. Cada reloj que cuelga de la pared o los controles remotos que controlan el televisor y el aire acondicionado funcionan con estas baterías alcalinas.
- Pila de botón
Como puede ver, la pila de botón tiene forma de botón que toma el cuerpo como cátodo y el ánodo está aislado en la parte superior de la batería. El cuerpo está hecho de acero inoxidable niquelado, un terminal positivo de la pila de botón. En la parte superior del CAN, puedes ver una cubierta de terminal negativo. Tanto el CAN como la tapa superior están separados por una junta fabricada en material aislante. Dentro de la batería hay dos materiales: litio metálico y dióxido de manganeso, separados por un separador. El electrolito utilizado en la batería es sal de litio en disolvente orgánico.

Pila de botón (fuente)
Las pilas de botón o de moneda se pueden ver en relojes de diferentes tamaños. Esto también entra en la categoría de pilas alcalinas porque se compone de tres sustancias: litio como ánodo y dióxido de manganeso como cátodo, y alcalinas como electrolito. Estas baterías se utilizan para alimentar dispositivos pequeños como relojes, memoria RAM de calculadoras de bolsillo, etc.
Baterías secundarias
Las baterías que se fabrican con fines reutilizables mediante recarga se denominan baterías secundarias . También se les llama baterías recargables . Tienen la misma reacción electroquímica que las pilas alcalinas, pero la reacción electroquímica se puede revertir. Este tipo de batería se utiliza para dispositivos portátiles como teléfonos móviles, portátiles, vehículos eléctricos, etc. Además, se utiliza una batería recargable con un inversor que almacena energía para alimentar nuestros dispositivos domésticos.
Algunas baterías secundarias comunes
- Baterías de plomo ácido
El contenedor de la batería de plomo-ácido está hecho de caucho duro a partir de un compuesto bituminoso. Del recipiente se obtiene ácido sulfúrico diluido, que es un electrolito. Las placas de plomo en forma de rejilla se sumergen en el electrolito. La placa positiva de la batería de plomo-ácido está hecha de peróxido de plomo (PbO2). Es una sustancia dura, quebradiza y de color marrón oscuro. La placa negativa está hecha de plomo puro en estado de esponja suave. Un separador separa ambos electrodos. Este separador puede estar fabricado a partir de celulosa, cloruro de polivinilo, caucho orgánico y poliolefinas. El positivo y el negativo están conectados en la parte superior de la batería, que es el terminal positivo y negativo externo para conectar la carga o el dispositivo. Hay una tapa de filtro con un pequeño agujero en el centro. La cubierta del filtro proporciona acceso para agregar electrolitos y los orificios permiten que los gases se liberen a la atmósfera.

Batería de plomo-ácido (fuente)
Estas baterías son económicas, fiables, más grandes y pesadas. Se utiliza principalmente en aplicaciones pesadas porque no es portátil debido a su peso y tamaño. Se utiliza en aplicaciones no portátiles como almacenamiento de energía de paneles solares, encendido e iluminación de vehículos, energía de respaldo y nivelación de carga en generación y distribución de energía.
- Baterías de níquel-cadmio
Una batería de níquel-cadmio (batería de Ni-Cd o NiCad) está hecha de hidróxido de óxido de níquel como cátodo y cadmio metálico como ánodo. En primer lugar, se mantiene una capa de óxido de níquel NiO2 alrededor del redox. Esta capa actúa como cátodo. Por encima de esta capa catódica, se construye un separador de KOH o NaOH para proporcionar iones OH. Después de esta capa, la capa de cadmio actúa como ánodo de la batería de ni-cd. La capa de níquel actúa como electrodo positivo y la capa de cadmio actúa como electrodo negativo. La disposición de capas se enrolla en forma cilíndrica en una caja. La caja exterior está fabricada en metal con placa de sellado y válvula de seguridad, que permiten la evacuación de los gases del recipiente. Una cubierta en la parte superior de la celda está aislada por una junta, que actúa como positivo para la batería de ni-cd.

Batería de níquel-cadmio. (Fuente)
Estas baterías tienen un coste relativamente menor, contienen materiales tóxicos y tienen una alta tasa de autodescarga. Tiene un mayor número de ciclos de carga y descarga. La densidad de energía es mayor que la de las baterías de plomo-ácido. Es más pequeño, ligero y está disponible en diferentes tamaños, como pilas alcalinas. Generalmente se utiliza en dispositivos de bajo coste como juguetes, luz solar o teléfonos inalámbricos, etc.
- Baterías de hidruro metálico de níquel
La batería de hidruro metálico de níquel (NiMH o Ni-MH) está hecha de hidróxido de óxido de níquel como cátodo y una aleación absorbente de hidrógeno como ánodo. La construcción de la batería Ni-MH es la misma que la de la batería Ni-cd. La capa de hidróxido de óxido de níquel y la aleación absorbente de hidrógeno se laminan con el separador de KOH o NaOH. La caja metálica exterior actúa como terminal negativo y está conectada con una aleación absorbente de hidrógeno. La tapa en la parte superior de la celda actúa como un terminal positivo y está conectada al hidróxido de óxido de níquel. Un anillo de sellado aislante o una junta separa los terminales negativo y positivo.

Batería de hidruro metálico de níquel. (Fuente)
En comparación con el Ni-Cd, estos son más eficientes, con mayor densidad energética, menos tóxicos y una menor tasa de autodescarga. Es relativamente caro en comparación con el Ni-Cd. Tiene resistencia a la sobrecarga y descarga excesiva. No es muy fácil de cargar y algunos fabricantes proporcionan cargadores específicos.
- Baterías de iones de litio
Las baterías de iones de litio tienen un ánodo de grafito y un cátodo de óxido metálico de litio. La sal de litio como disolvente orgánico se utiliza como electrolito. Cuando la batería está conectada al circuito o carga, el ion de litio migra del electrodo negativo al electrodo positivo.
En la imagen siguiente, la construcción de la batería de iones de litio es similar a la de las baterías de Ni-Cd y Ni-NH, excepto por los materiales. El óxido metálico de litio está recubierto con una lámina de aluminio, que es el electrodo positivo. El grafito está recubierto con una lámina de cobre que es el electrodo negativo. Ambas láminas se enrollan en forma cilíndrica con un separador entre ellas. Se rocía al espectador con material electrolítico que suele ser sal de litio como disolvente orgánico. La carcasa metálica exterior es negativa y la cubierta superior es el terminal positivo. Ambos están separados por una junta de material aislante.

Batería de iones de litio. (Fuente)
Las baterías de iones de litio se utilizan en teléfonos móviles, ordenadores portátiles y muchos dispositivos portátiles. También se utiliza en el sector militar y aeroespacial debido a su naturaleza liviana. Tiene mayor densidad de energía y baja autodescarga en comparación con otros tipos de baterías. También está disponible en varios tamaños. Su voltaje unicelular es mayor. Presentan un riesgo importante de explosión en caso de cortocircuito o daño externo.