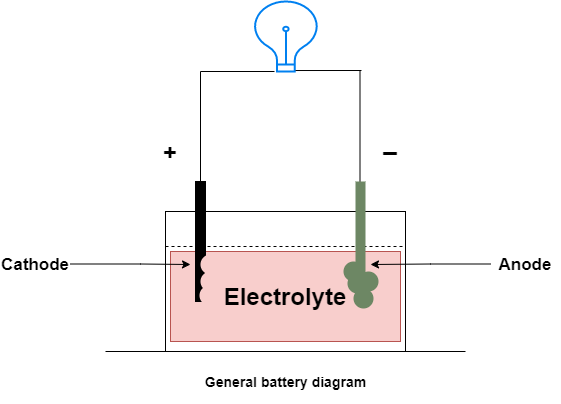
La batería almacena energía eléctrica en forma de energía química y la energía química a su vez se puede convertir en energía eléctrica. La conversión de energía química en energía eléctrica se llama descarga. La reacción química durante la descarga hace que los electrones fluyan a través de la carga externa conectada en los terminales, lo que hace que la corriente fluya en la dirección inversa al flujo de electrones.
Algunas baterías son capaces de devolver estos electrones al mismo electrón aplicando corriente inversa. Este proceso se llama carga. Las baterías capaces de recuperar electrones en un mismo electrodo se denominan recargables y si no son capaces de hacerlo se denominan no recargables.
En una batería, el electrodo donde ocurre la reducción se llama cátodo y donde ocurre la oxidación se llama ánodo.

Existen tres tipos de baterías en el mercado que se utilizan habitualmente como baterías recargables.
- Baterías de plomo ácido
- Baterías Ni-Cd
- Baterías Ni-MH
- Baterías de iones de litio
Baterías de plomo ácido
En primer lugar, la batería de plomo-ácido fue inventada en 1859 por el físico francés Gaston Plante. Es un electrodo negativo (ánodo) hecho de plomo esponjoso o poroso. El electrodo positivo (cátodo) está compuesto de óxido de plomo. Los electrodos de ánodo y cátodo se sumergen en una solución electrolítica de ácido sulfúrico y agua (ácido sulfúrico diluido).

Baterías de plomo ácido
La membrana químicamente permeable separa los dos electrodos, lo que evita cortocircuitos. Esta membrana también evita cortocircuitos a través del electrolito.
La batería de plomo-ácido tiene un voltaje nominal de aproximadamente 2 V, que puede variar desde 1,8 V en carga con descarga completa hasta 2,40 V en circuito abierto con carga completa. El cálculo del voltaje de carga se puede realizar con un voltaje de 2,40v/celda. La batería de plomo-ácido de 12 V se puede fabricar con 6 celdas conectadas en serie. La capacidad actual depende totalmente del fabricante y del tamaño, y puede variar desde aproximadamente 1 Ah hasta casi 150 Ah. Por ejemplo, se pueden usar 12 V con 4 Ah o más para el encendido del vehículo, y 12 V con una batería de 150 Ah para un inversor.
Descarga de baterías de plomo-ácido.
Cuando la batería está conectada a una carga, la batería comienza a descargarse. El ácido sulfúrico (H2SO4) se divide en dos partes, iones hidrógeno (2H ++ ) e iones sulfato (SO 4 – ). El ion hidrógeno toma un electrón del electrón positivo y los iones sulfato ceden un electrón a la placa negativa. Esta desigualdad de electrones hace que el flujo de corriente en la carga externa equilibre la desigualdad de los electrodos.

Descarga de batería de plomo-ácido
Reacción en el electrodo negativo.
Pb + HSO 4 – ———-> PbSO 4 +H + + 2e –
Reacción en el electrodo positivo.
PbO 2 + HSO 4 – + 3H + + 2e – ———-> PbSO 4 + 2H 2 Ó
reacción general
Plomo + PbO 2 + 2H 2 SO 4 ———-> 2PbSO 4 + 2H 2 Ó
La descarga de la batería de plomo-ácido provoca la formación de cristales de sulfato de plomo (PbSO 4 ) tanto en el electrodo positivo (cátodo) como en el electrodo negativo (ánodo) y libera electrones debido al cambio en la carga de valencia del plomo. Esta formación de sulfato de plomo utiliza sulfato de ácido sulfúrico, que es un electrolito de batería. Esto hace que el ácido sulfúrico esté menos concentrado en la descarga completa, ambos electrodos están cubiertos con sulfato de plomo y agua, no hay ácido sulfúrico alrededor del electrodo. El electrodo queda completamente cubierto con el mismo material cuando se descarga por completo. El material es sulfato de plomo, por lo que no hay potencial químico ni voltaje entre los dos electrodos. En la práctica, hay una tensión de corte para detener la descarga, mucho antes de este punto.
Averigüemos la tasa de descarga de una batería de plomo-ácido generalmente especificada para 8, 10 o 20 horas, que es C/8, C/10, C/20. si encuentras baterías de clasificación 12v 200Ah/10h o C/10.
La tasa de descarga es C/10 = 200 Ah / 10 h = 20A
C/10m corta la tensión después de un tiempo determinado, aquí 10 horas para C/10.
Carga de baterías de plomo-ácido
La carga comienza cuando el cargador se conecta a los terminales positivo y negativo. la batería de plomo-ácido convierte el sulfato de plomo (PbSO 4 ) en el electrodo negativo en plomo (Pb) y en el terminal positivo, la reacción convierte el sulfato de plomo (PbSO 4 ) en óxido de plomo. Las reacciones químicas se invierten desde el proceso de descarga.

Carga de baterías de plomo-ácido
Reacción en el electrodo positivo.
PbSO 4 + 2H 2 O ———-> PbO 2 + HSO 4 – + 3H + + 2e –
Reacción en el electrodo negativo.
PbSO 4 + E + + 2e – ———-> Pb + HSO 4 –
Reacción general
2PbSO 4 + 2H 2 O ———-> Pb + PbO 2 + 2H 2 SO 4
La corriente de carga electroliza el agua en el electrolito y se producen tanto hidrógeno como oxígeno en este proceso llamado "gasificación" de la batería. Esta gasificación plantea varios problemas en la batería. Esto no es seguro debido a la naturaleza explosiva del hidrógeno producido. Esto también reduce el agua en la batería, que se puede reemplazar manualmente, pero agrega un factor de mantenimiento. La formación de gases puede provocar sombras en el material activo del electrolito, lo que reduce permanentemente la capacidad de la batería, por lo que la batería no debe cargarse regularmente por encima del voltaje que provoca la formación de gases. El voltaje de gasificación se puede cambiar con la tasa de carga.
Existen varios métodos para cargar baterías de plomo-ácido. Pero debemos utilizar el mejor método para reducir la posibilidad de formación de gases, para obtener la máxima duración y capacidad de la batería. La lista de métodos de facturación se proporciona a continuación.
- Voltaje constante: como su nombre lo indica, este método proporcionará un voltaje constante hasta que la corriente consumida por la batería llegue a cero. Toma mucho tiempo
- Corriente constante: - Como nombre, este método proporcionará corriente constante hasta que el voltaje alcance el voltaje de gasificación establecido. También lleva mucho tiempo.
- Corriente constante de varios pasos: – En este método, la corriente de carga es constante cuando el voltaje alcanza el voltaje de gasificación y la corriente comienza a reducirse en pasos para mantener el voltaje por debajo del voltaje de gasificación. Este cargador es complicado de construir.
- Corriente de voltaje constante modificada: – En este método, la batería se carga en tres etapas. La primera etapa es la etapa de corriente constante, en la que se aplica corriente a la batería hasta que el voltaje alcanza el voltaje de gasificación establecido. En la segunda etapa, el voltaje es constante hasta que la corriente disminuye aproximadamente 0,1C20 (también conocido como C20/10). El voltaje se reducirá a voltaje de flotación (generalmente de 2,25 V a 2,27 V) para mantener la batería cargada.
La corriente de carga y el voltaje de gasificación se pueden encontrar en la etiqueta de la batería, como puede ver en la imagen, hay dos modos para elegir el voltaje y la corriente de carga: uso en espera y uso cíclico. El uso cíclico es el uso de una batería donde es necesario cargarla y descargarla rápidamente. El uso en espera es cuando la batería ya está cargada y se usa cuando es necesario. 0,1C significa multiplicar 0,1 por la capacidad total de la batería. Si tiene una batería de 40 Ah, significa que 0,1 C es 0,1 x 40 = 4 A. Lo mismo para 0,25C = 0,25 x 40 = 10A.

Instrucciones para la batería de plomo ácido
El ciclo de vida de las baterías de plomo-ácido.
El ciclo de vida de una batería de plomo-ácido depende de varios factores. Generalmente, decimos que su ciclo de carga/descarga es de alrededor de 200 a 300 ciclos para baterías de ciclo superficial, pero este número puede aumentar o disminuir. El ciclo de vida de esta batería depende de tres factores: profundidad de descarga, correcto ciclo de carga y temperatura. La batería de ciclo profundo puede mantener un ciclo de vida de aproximadamente 1000, pero ¿qué son el ciclo pálido y el ciclo profundo? , puedes encontrarlo a continuación.
-
Profundidad de descarga: la profundidad de descarga (DOD) significa cuánto está descargada la batería. Supongamos que tiene una batería de 100 Ah, la descargó durante 20 minutos a 50 A, luego la profundidad de descarga se indica a continuación.
Tiempo secreto en horas = 20/60
Calcular el tiempo de descarga = 50 x 20/60 = 16,7 A
Profundidad de descarga = (descarga/capacidad) x 100 = (16,7/100) x 100 = 16,7%
Hay dos tipos de baterías según el DOD: la batería que tiene una capacidad DOD de más del 50 % se llama batería de ciclo profundo y la batería que se ha cortado antes del 50 % del DOD se llama batería de ciclo superficial . La batería de ciclo profundo puede mantener un ciclo de vida de aproximadamente 1000 incluso si la profundidad de descarga es superior al 50%, pero la batería de ciclo superficial puede aumentar su ciclo de vida como se muestra a continuación.

Relación entre la capacidad de la batería, la profundidad de descarga y la vida útil de la batería en el ciclo superficial
- Carga: Si la carga no es correcta, se producirá una sobrecarga o una carga insuficiente, lo que también reduce la capacidad de la batería.

- Temperatura: el ciclo de vida también se ve afectado por la temperatura, la capacidad de la batería se reduce en el funcionamiento a baja temperatura, el funcionamiento a alta temperatura aumenta la tasa de envejecimiento de la batería.
Baterías Ni-Cd
En primer lugar, la batería de Ni-Cd fue inventada en 1899 por Waldermar Jungner. su electrodo positivo (cátodo) fabricado de hidróxido de óxido de níquel (NiO(OH)) y un electrodo negativo (ánodo) fabricado de cadmio metálico (Cd). El electrolito utilizado es hidróxido de potasio (KOH) al 30% en agua destilada. El nivel del electrolito se mantiene justo por encima de la parte superior del electrodo. No se producen cambios apreciables en el electrolito durante la carga y descarga.

(batería de Ni-Cd)
Esta batería tiene un ciclo de descarga/carga de alrededor de 2000 ciclos. Su voltaje nominal es de 1,2 V por celda y su voltaje de carga completa es de 1,55 V. Se descarga completamente cuando el voltaje cae a 1,1 V. El voltaje se puede aumentar conectando celdas en serie. El fabricante define la capacidad de la batería, normalmente la batería AA disponible se acerca a los 1000 mAh.
Descarga de baterías Ni-Cd
La batería comienza a descargarse cuando la carga está conectada a los terminales. El hidróxido de potasio (KOH) se disocia en iones potasio (K + ) e hidroxilo (OH – ). Los iones hidroxilo (OH – ) van hacia el electrodo negativo. El electrodo negativo libera el electrón y el electrodo positivo lo recibe a través de una conexión externa. Esto hace que la corriente fluya a través de la carga desde el electrodo positivo al negativo.

Descarga de la batería de Ni-Cd
Reacción en el electrodo negativo.
Cd + 2OH ———-> Cd(OH) 2 + 2e –
Reacción en el electrodo positivo.
NiO(OH) +H 2 O + 2e – ———->Ni(OH) 2 + AH –
Reacción general
Cd + 2NiO(OH) + 2H2Ó ———->2Ni(OH) 2 +Cd(OH) 2
La tasa de descarga varía según el tamaño de la batería. Una batería AA estándar puede entregar una corriente de aproximadamente 1,8 amperios y una batería de tamaño D puede entregar una corriente de aproximadamente 3,5 amperios.
Carga de baterías Ni-Cd
Durante la carga, el cargador se conecta a los terminales. La reacción se invierte tras la descarga. El electrodo positivo convierte Ni(OH) 2 en NiO(OH) y libera el electrón. El electrón es tomado por un electrón negativo de conexiones externas y convierte Cd(OH) 2 en CD.

Carga de batería Ni-Cd
Reacción en el electrodo positivo.
Ni(OH) 2 + AH – ———->NiO(OH) +H 2 O + 2e –
Reacción en el electrodo negativo.
Cd(OH) 2 + 2e – ———-> Cd + 2OH
reacción general
2Ni(OH) 2 +Cd(OH) 2 ———-> Cd + 2NiO(OH) + 2H 2 Ó
Al final del ciclo de carga, las celdas emiten gas y esto también ocurrirá cuando la celda esté sobrecargada. A partir de este gas, el agua del electrolito se descompondrá en hidrógeno en el electrodo negativo y oxígeno en el electrodo positivo. Esta gasificación depende del voltaje utilizado para cargar la celda y de la temperatura. Para cargar completamente la batería de Ni-cd, debe producirse una ligera formación de gases, por lo que se utiliza un poco de agua de la concentración de electrolito.
Existen dos métodos para cargar baterías de ni-cd. Carga lenta y carga rápida.
- Carga lenta: – La corriente de carga lenta es de aproximadamente 0,1 C y no dañará la celda cuando esté completamente cargada. Este método también se utiliza para superar la autodescarga de las baterías de ni-cd.
- Carga rápida: – En la carga rápida, la celda se carga a una corriente constante de aproximadamente 1C. C es la capacidad de la batería; si está utilizando una batería de 4 Ah, entonces 1 C significa 1 x 4 = 4 A. Una vez completamente cargada, esto puede detectarse mediante el algoritmo de detección de carga que se proporciona a continuación. La corriente se reducirá a 0,1 C y se aplicará una carga lenta. La carga lenta es cargar al mismo ritmo que la batería se descarga automáticamente. Esto mantendrá la batería completamente cargada.
El algoritmo de detección de carga completa puede utilizar dos factores Delta V o de temperatura negativos.
Si el algoritmo utiliza la temperatura para detectar, la temperatura será de 45 grados para carga rápida y de 50 grados para carga lenta.
En el algoritmo de detección delta V negativo, el voltaje cae después de una carga completa. La detección de esta caída se puede utilizar para detectar el estado de carga completa. Este método se llama delta V negativo. Este método proporciona una detección precisa de la carga completa.
Baterías Ni-MH
En primer lugar, la batería Ni-MH fue inventada en 1967 por el Centro de Investigación Battelle-Ginebra. Luego fue lanzado en 2005 por Sanyo, bajo la marca Eneloop. En esta batería, un electrodo positivo (cátodo) está hecho de hidróxido de óxido de níquel y un electrodo negativo está hecho de una aleación absorbente de hidrógeno (hidruro metálico). El electrolito utilizado es hidróxido de potasio (KOH) concentrado con agua destilada.

Batería Ni-MH
Esta batería tiene un ciclo de descarga/carga de aproximadamente 180 a 2000 ciclos . Esto depende de varios factores, como por ejemplo cómo estás cargando o descargando la batería.
Esta batería es casi similar a la batería de Ni-Cd. El voltaje nominal de la batería Ni-MH es de 1,2 V para una sola celda. Pero con carga completa, el voltaje es de 1,5 V y el voltaje de descarga total es de 1,0 V. La capacidad actual de esta batería varía según su tamaño; una batería AA puede estar disponible cerca de 2000 mAh.
Descarga de baterías Ni-MH
La reacción de descarga comienza cuando la carga se conecta a los terminales. El hidruro metálico (MH) reacciona con iones OH para formar M y agua, y también libera un electrón. El electrón es tomado por el NiO (OH) a través de una carga externa. Esto hace que la electricidad fluya a través de la carga.

Descarga de la batería Ni-MH
Reacción en el electrodo negativo.
MH + OH – ———->M +H 2 O + e –
Reacción en el electrodo positivo.
NiO(OH) +H 2 O + e – ———->Ni(OH) 2 + AH –
Reacción general
NiO(OH) +MH ———->Ni(OH) 2 +M
Normalmente, la batería Ni-MH se descarga a una velocidad de 3 C (donde C es la capacidad de la batería, pero una batería de alta calidad puede descargarse hasta una velocidad de 15 C).
Carga de baterías Ni-MH
Durante la carga, el cargador está conectado al terminal de la batería y las reacciones de carga son inversas a las reacciones de descarga. El electrodo positivo convierte Ni(OH) 2 en NiOOH, agua y libera un electrón. Este electrón es eliminado por el electrodo negativo del cable exterior y nuevamente por el MH.

Carga de batería Ni-MH
Reacción en el electrodo positivo.
Ni(OH) 2 + AH – ———-> NiO(OH) +H 2 O + e –
Reacción en el electrodo negativo.
METRO +H 2 O + e – ———->MH+OH –
Reacción general
Ni(OH) 2 + M ———-> NiO(OH) +MH
Los productos químicos de carga de baterías Ni-MH utilizan algoritmos de corriente y voltaje constantes que se pueden dividir en cuatro partes que se detallan a continuación.
- Carga lenta: - Cuando la batería está completamente descargada, cae por debajo de 0,9 V por celda. La corriente constante de un máximo de 0,1 C utilizada para cargar la batería se denomina carga lenta.
- Corriente constante: cuando el voltaje es superior a 0,9 V por celda, se aplica una corriente constante en el rango de 0,2 C a 1 C para realizar una carga de corriente constante.
- Terminación de la carga: – La carga completa de la batería se puede detectar mediante un algoritmo de detección de carga completa que se explica a continuación. Después de la carga completa, se utiliza la carga lenta a la velocidad de autodescarga para mantener la carga completa de la batería.
El algoritmo de detección de carga completa puede utilizar dos factores Delta V o de temperatura negativos.
Si el algoritmo utiliza la temperatura para detectar, la temperatura será de 45 a 50 grados para detectar la carga completa.
En el algoritmo de detección delta V negativo, el voltaje cae después de una carga completa. La detección de esta caída se puede utilizar para detectar el estado de carga completa. Este método se llama delta V negativo. Este método proporciona una detección precisa de carga completa.
Baterías de iones de litio
En primer lugar, Akira Yoshino desarrolló una batería de iones de litio en 1985. El electrodo positivo (cátodo) está hecho de óxido de litio y cobalto y el electrodo negativo (ánodo) está hecho de grafito. La sal de litio como disolvente orgánico se utiliza como electrolito. Se utiliza un separador para separar los electrodos.

Batería de iones de litio
Esta batería tiene un ciclo de descarga/carga de aproximadamente 400 a 1200 ciclos. Esto depende de varios factores, como por ejemplo cómo estás cargando o descargando la batería.
El voltaje nominal de la batería de iones de litio es de 3,60 V. Cuando la batería está completamente cargada, el voltaje es de aproximadamente 4,2 V. Cuando la batería está completamente descargada, el voltaje es de aproximadamente 3,0 V La batería de iones de litio viene en diferentes tamaños y formas , la capacidad también está disponible según los requisitos.
Descarga de baterías de iones de litio
En el momento de la descarga de la batería, la carga se conecta al terminal de la batería. El ion litio se libera del electrodo negativo y pasa al electrolito. Este ion de litio es absorbido por un electrodo positivo. El electrodo negativo también libera electrones que viajan a través de un cable externo hasta el electrodo positivo. Esto nos proporciona una corriente eléctrica para nuestro circuito.

Descarga de la batería de iones de litio
(Descarga de la batería de iones de litio)
Reacción en el electrodo negativo.
LiC 6 ———-> C 6 +Li + +e –
Reacción en el electrodo positivo.
CoO 2 + Li + e – ———-> LiCoO 2
Reacción general
LiC 6 + CoO 2 ———->C 6 + LiCoO 2
La batería de iones de litio se puede descargar a una velocidad de 10 °C (donde C es la capacidad de la batería). Si su batería puede suministrar 1000 mAh, la tasa de descarga será 10 x 1000 = 10000 mAh.
Carga de baterías de iones de litio
Al cargar la batería de iones de litio, la batería se conecta al cargador. El electrodo positivo pierde un electrón cargado negativamente. Para mantener este equilibrio de carga en el electrodo negativo, se disuelve un número igual de iones cargados positivamente en la solución electrolítica. Estos iones de litio viajan hasta el electrodo positivo, donde son absorbidos por el grafito. Esta reacción de absorción también deposita electrones en el ánodo de grafito para "unir" el ion litio.

Carga de batería de iones de litio
Reacción en el electrodo positivo.
LiCoO 2 ———->CoO 2 + Li + e –
Reacción en el electrodo negativo.
C6 +Li + +e – ———-> LiC 6
Reacción general
C 6 + LiCoO 2 ———-> LiC 6 + CoO 2
Los productos químicos de carga de baterías de iones de litio utilizan algoritmos de corriente y voltaje constantes que se pueden dividir en cuatro partes.
- Carga lenta: – Cuando la batería está profundamente descargada, cae por debajo de 3,0 V por celda. La corriente constante de un máximo de 0,1 C utilizada para cargar la batería se denomina carga lenta.
- Corriente constante: cuando el voltaje es superior a 3,0 V por celda, se aplica una corriente constante en el rango de 0,2 C a 1 C para realizar una carga de corriente constante.
- Tensión constante:- cuando la tensión se alcanza a 4,2 V por celda de carga de corriente constante. Se aplica un voltaje constante hasta que la corriente consumida por la celda cae a cero, lo que maximiza el rendimiento de la batería.
- Terminación de la carga: – El final de la carga se detecta mediante un algoritmo que detecta el rango de corriente que cae de 0,02 C a 0,07 C o utiliza un método de temporizador. Detecta cuando se inicia una etapa de voltaje constante y apaga el cargador después de 2 horas de etapa de voltaje constante.